按照构造原理,可将电子填入各能层、能级,得到电子排布式。能级中的电子在原子轨道(空间运动状态)中怎样排布,怎样运动?
1、能量最低原理
不管是宏观物质,还是微观粒子,能量越低的状态就是越稳定的状态。
能量最低原理:基态是能量最低的状态,基态原子的电子排布是能量最低的原子轨道的组合。由此,在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低。
按构造原理,会有能级交错现象。还有,24号元素铬和29号元素铜的价层电子排布是

本图与文章内容无关
整个原子的能量由核电荷数、电子数和电子状态三个因素共同决定。相邻能级能量相差很大时,电子填入能量低的能级,可使整个原子能量最低(如所有主族元素的基态原子);而当相邻能级能量相差不大时,有1-2个电子占据能量稍高的的能级,可能反而降低了电子排斥力能使整个原子能量最低(如所有副族元素的基态原子)。
2、电子自旋与泡利原理
s、p、d、f……能级的原子轨道数分别为1、3、5、7……,而它们最多容纳电子数分别为:1×2=2、3×2=6、5×2=10、7×2=14……,也就是每个原子轨道最多容纳2个电子,这2个电子的空间运动状态相同。
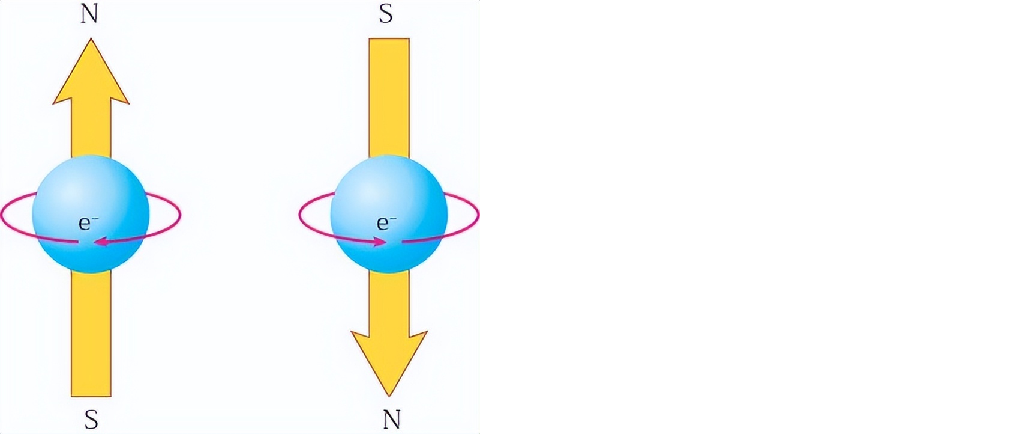
电子自旋:电子除了空间运动状态外,还有一种状态——自旋。电子自旋在空间有顺时针和逆时针两种取向,简称自旋相反,常用上下箭头“↑”和“↓”表示自旋相反的电子。
泡利原理:在一个原子轨道里,最多只容纳2个电子,且自旋相反,也称泡利不相容原理。
也可表述为,一个原子里没有运动状态完全相同的两个电子,即一个原子里有多少个电子就有多少种运动状态。

本图与文章内容无关
注意:一个原子轨道是一个空间运动状态,一个电子就有一种运动状态。如Na原子的电子排布式为
3、电子排布的轨道表示式
综合前面的学习,我们要描述一个电子的运动状态,需要指明其所在的能层、能级、原子轨道和电子自旋四个运动函数。可用轨道表示式(又称电子排布图)更准确地表示核外电子排布。
轨道表示式:用方框(或圆圈)表示原子轨道,能量相同的原子轨道(简并轨道,即同一能级的原子轨道)的方框相连。在方框的下方或上方标记能级符号。用箭头表示一种自旋状态的电子,“↑↓”表示电子对(成对电子),“↑”或“↓”表示单电子(或未成对电子)。

本图与文章内容无关
如,铝原子的轨道表示式。
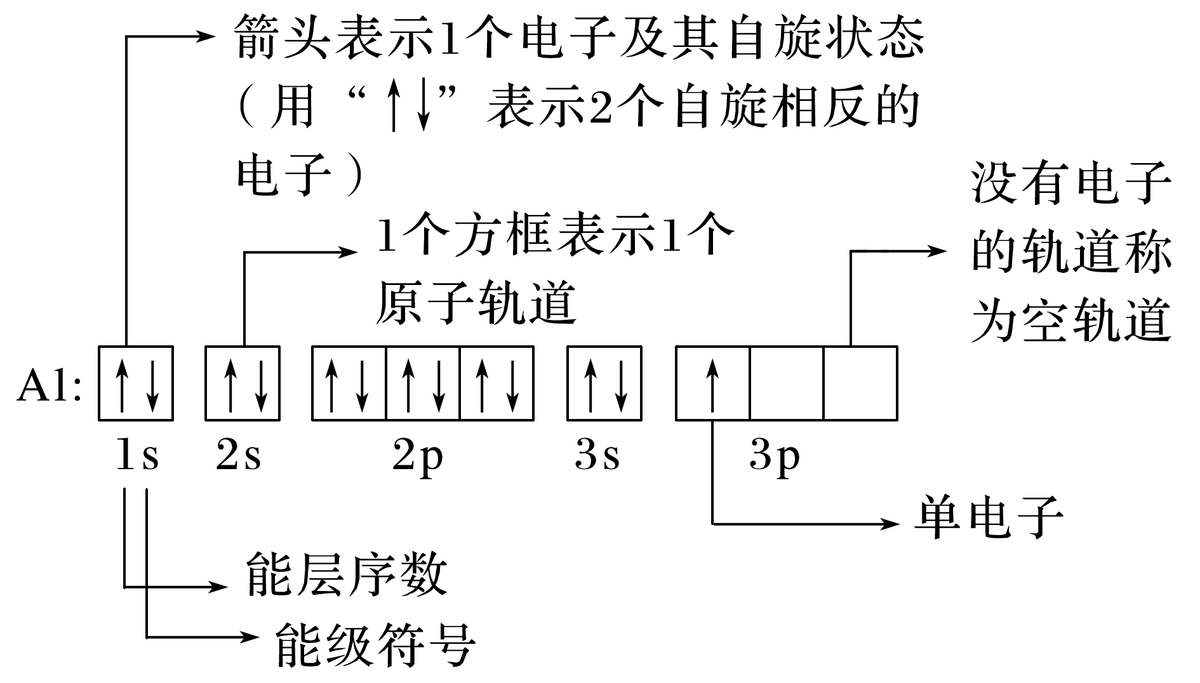
在铝原子中,有6个电子对,1个单电子,有7种空间运动状态,即7个原子轨道,13个电子就有13种电子运动状态。
还可以画出的能级上下错落,以表示能量的高低不同。如下面的几种原子的轨道表示式(图中没有标出能级符号)。

4、洪特规则
洪特规则:基态原子中,填入简并轨道的电子总是先单独分占不同的原子轨道,且自旋平行(自旋方向相同)。
本图与文章内容无关
思考:下列轨道表示式中哪个是氧的基态原子?为什么?
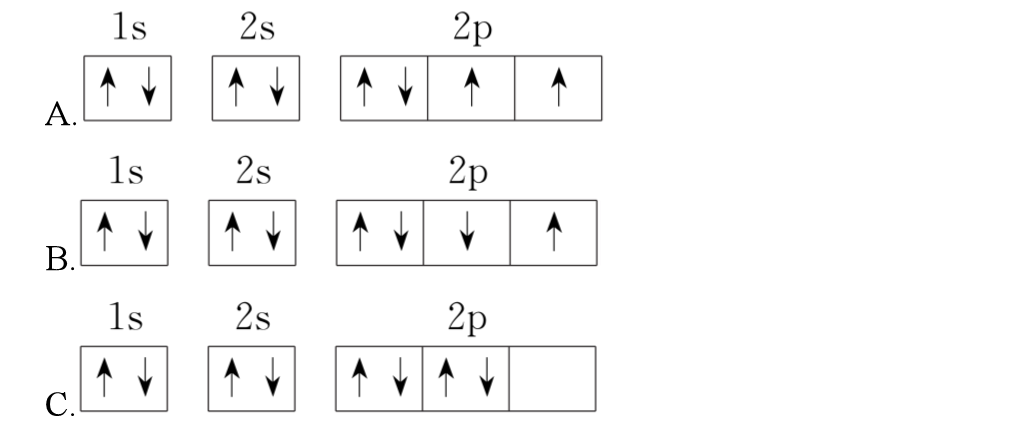
根据洪特规则,基态原子中,填入简并轨道的电子总是先单独分占不同原子轨道,C不正确。且电子自旋平行,B不正确,A正确。
洪特规则还有一种情况:在简并轨道上的电子排布处于全充满、半充满或全空状态时,能量较低,相对比较稳定。


本图与文章内容无关
注意:洪特规则不仅适用于基态原子,也适用于基态离子。洪特规则是针对电子填入简并轨道而言的,并不适用于电子填入能量不同的轨道。
小结:基态原子核外电子排布遵循能量最低原理,构造原理、泡利原理、洪特规则都与之保持一致。


















